Эндонуклеаза рестрикции PecI из бактериального штамма Paracoccus species 12 узнает последовательность ДНК 5’-TTA^TAA-3’ и является изошизомером PsiI
Д.А. Гончар, В.А. Чернухин, В.С. Дедков, Н.А. Михненкова, М.А. Абдурашитов, О.А. Беличенко, С.Х. Дегтярев.
Д.А. Гончар1, В.А. Чернухин1, В.С. Дедков1, Н.А. Михненкова1, М.А. Абдурашитов1, О.А. Беличенко1, С.Х. Дегтярев1
1 ОOO «СибЭнзайм» Новосибирск
* автор для переписки: Данила Гончар, ООО СибЭнзайм, ул. Тимакова, д. 2/12 , Новосибирск, 630117, Россия; тел.: +7(383)333-4991; факс: +7(383)333-6853; E-mail: gonchar@sibenzyme.ru
Нами обнаружен бактериальный штамм Paracoccus species 12, который является продуцентом новой эндонуклеазы рестрикции, названной PecI. Этот фермент узнает шестинуклеотидную палиндромную последовательность ДНК 5’-TTA^TAA-3’ и расщепляет ее с образованием «тупых» концов, как показано стрелкой. Таким образом, PecI является истинным изошизомером рестриктазы PsiI [1].
Препарат эндонуклеазы рестрикции PecI с концентрацией 10000 ед/мл был получен путем очистки в четыре хроматографические стадии. Оптимальными условиями реакции фермента являются SE-буфер 5 (Y) (33 мМ Трис-ацетат (pH 7.9), 10 мМ Mg-ацетат, 66 мМ K-ацетат, 1 mM ДТТ) и температура 37oС.
Принятые сокращения: BSA – бычий сывороточный альбумин; ДТТ – дитиотреитол; ПААГ – полиакриламидный гель; п.н. – пары нуклеотидов; система РМ – система рестрикции-модификации; Трис – трис-(оксиметил)-аминометан; ЭДТА – этилендиаминтетрауксусная кислота; ЭР –эндонуклеаза рестрикции.
Ключевые слова: эндонуклеазы рестрикции, изошизомеры
DOI: 10.26213/SE.2024.47.21.001
Данные для цитирования:
Д.А. Гончар, В.А. Чернухин, В.С. Дедков, Н.А. Михненкова, М.А. Абдурашитов, О.А. Беличенко, С.Х. Дегтярев. (2024) Эндонуклеаза рестрикции PecI из бактериального штамма Paracoccus species 12 узнает последовательность ДНК 5’-TTA^TAA-3’ и является изошизомером PsiI, ДНК-узнающие ферменты, том 2024(1), DOI: 10.26213/SE.2024.47.21.001

Эта статья доступна по лицензии Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовались реактивы производства “Sigma-Aldrich” (США), “Fisher” (Германия), “Panreac” (Испания), “Диа-М” и “Хеликон” (Россия). Для хроматографической очистки фермента применялись следующие носители: фосфоцеллюлоза P11, гепарин-сефароза (“Sigma”, США), Bio-Gel A-1,5m, гидроксиапатит (BioRad, США). Для выращивания бактериальных клеток использовались компоненты питательной среды фирмы ”Organotechnie” (Франция).
Для экспериментов брали эндонуклеазы рестрикции, полинуклеотидкиназу фага Т4, препарат ДНК фага Лямбда, маркеры молекулярного веса ДНК, реакционные SE-буферы “B100”, “B”, “G”, “O”, “W”, “Y”, “ROSE” производства ООО “СибЭнзайм” (Россия).
Морфологические и физико-биохимические свойства штамма изучали с использованием методик [2]. Определение рода микроорганизма проводили по определителю Берджи [3] и по результатам секвенирования ПЦР-фрагмента гена 16S рРНК.
Для определения места гидролиза межнуклеотидных связей использовали [32P]-меченый ДНК-дуплекс, содержащий сайт узнавания целевого фермента. Исходные олигодезоксирибонуклеотиды были синтезированы в компании “ДНК-Синтез” (Россия) и метились с помощью Т4-полинуклеотидкиназы. Для разделения продуктов ферментативного гидролиза меченых олигонуклеотидов применяли электрофорез в 20% ПААГ, содержавшем 8 М мочевину.
Выращивание клеток штамма P. species 12
Клетки штамма Paracoccus species 12 выращивались в термостатированной качалке при 30oС в 0,5-литровых колбах с питательной средой LM (1% триптон, 0,5% дрожжевой экстракт, 0,5% NaCl, pH 7,5) с добавлением 0,1% MgCl2. Культура росла в течение 20-ти часов при 130 об/мин до оптической плотности A550=2,0±0,5 о.е. Клетки собирались центрифугированием при 6000 об/мин в течение 30 мин на центрифуге J2-21 “Beckman” (США). Биомасса хранилась при –20 oС.
Тестирование рестриктазной активности PecI
Для тестирования активности рестриктазы PecI в клетках 1 мл выросшей культуры переносили в 1,5-мл пробирки “Eppendorf” и центрифугировали при 5000 g
в течение 2 мин на микроцентрифуге “Eppendorf 5804” (Германия). Осадок суспендировали в 180 мкл воды и готовили грубый лизат клеток по методу, описанному ранее [4]. Затем аликвоту грубого лизата 5 мкл добавляли к 20 мкл реакционной смеси, содержавшей 1 мкг субстрата в реакционном буфере, и ставили серию разведений в 4 и 16 раз. Смесь инкубировали в термостате на 37oС в течение 1 ч. Продукты реакции наносили на 0,8% агарозный гель и проводили электрофорез в Трис-ацетатном буфере (50 мМ Трис-ацетат (pH 8,0), 20 мМ Na-ацетат, 2 мМ ЭДТА) при напряжении 120 V. После окрашивания бромистым этидием гель фотографировали в УФ-свете. В качестве субстрата для анализа рестриктазной активности использовали ДНК фага Лямбда. При тестировании активности ЭР PecI в хроматографическом профиле аликвоты по 1 мкл из фракций добавляли к 20 мкл реакционной смеси, содержащей 1 мкг ДНК фага Лямбда в SE-буфере “Y”, инкубировали смесь в течение 15 мин при 37oС и проводили электрофорез. При тестировании активности очищенного препарата PecI брали 1 мкл неразбавленного фермента или 0,5, 1 и 2 мкл препарата PecI, разбавленного в 10 раз SE-буфером “B100”. Фермент добавляли к 50 мкл реакционной смеси, содержащей 1 мкг ДНК фага Лямбда и один из шести реакционных буферов для эндонуклеаз рестрикции. Смесь инкубировали в течение 1 ч при 37oС и проводили электрофорез в агарозном геле.
Очистка препарата фермента ЭР PecI
Условия проведения выделения и используемые буферы. Выделение проводили при +4оС с использованием растворов на основе буферов:
- буфер А — 10 мМ Трис-HCl pH 7,6; 0,1 мМ ЭДТА и 7 мМ β-меркаптоэтанол;
- буфер Б -10 мМ К-фосфат pH 7,5; 0,1 мМ ЭДТА и 7 мМ β-меркаптоэтанол.
Экстрагирование. 15 г биомассы суспендировали в 75 мл буфера А, содержащего 0,1% тритон Х–100, 0,2 M NaCl, 1 мг/мл лизоцим, 0,1 мМ PMSF (фенилметил-сульфонилфторид – ингибитор протеаз). После 1 часa перемешивания на магнитной мешалке суспензию клеток в стеклянном стакане на 150 мл термостатировали в ледяной бане и затем клетки разрушали ультразвуком при максимальной мощности с амплитудой 22–24 мкм на приборе Soniprep 150 («MSE», Англия) с насадкой диаметром 2 см десятью импульсами по 1,5 мин с интервалом 2 мин. Экстракт осветляли на центрифуге J2-М1 («Beckman», США) в течение 30 минут в роторе JA-20 при 15000 об/мин. Осадок отбрасывали.
Гель-фильтрация на биогеле. Супернатант наслаивали на колонку, заполненную 500 мл Bio-Gel A-1,5m, уравновешенного буфером А, содержащим 0,1% Тритон X-100 и 0,8 М NaCl. Элюцию проводили буфером А, содержащим 0,1% Тритон X-100 и 0,8 М NaCl. Фракции, содержащие максимум активности, собирали и диализовали против 3 литров буфера А в течение 2,5 часов, а затем наносили на колонку с фосфоцеллюлозой P-11 объёмом 30 мл, предварительно уравновешенную буфером А с 0,1 М NaCl.
Хроматография на фосфоцеллюлозе Р-11. Колонку промывали 60 мл буфера А с 0,1 М NaCl. Сорбированный материал элюировали линейным градиентом концентрации NaCl от 0,1 М–0,6 М в буфере А, объемом 400 мл. Собирали 50 фракций по 8 мл. Объединяли фракции, содержащие максимум активности, и наносили на колонку с гидроксилапатитом объемом 5 мл, уравновешенную буфером Б.
Хроматография на гидроксилапатите. Колонку промывали 10 мл буфера Б. Фермент элюировали линейным градиентом 10–100 мМ калий–фосфатного буфера (рН 7,5) в буфере Б c 0,05 M NaCl объемом 150 мл. Собирали 50 фракций по 3 мл. Объединяли фракции с максимальной активностью и диализовали против 1 литра буфера А в течение 1,5 часов, а затем наносили на колонку с гепарин-сефарозой, объемом 2 мл, предварительно уравновешенную буфером А с 0,05 М NaCl.
Хроматография на гепарин-сефарозе. Колонку промывали 10 мл буфера А с 0,05 М NaCl. Сорбированный материал элюировали линейным градиентом концентрации NaCl 0,05–0,5 М в буфере А, объемом 150 мл. Собирали 50 фракций по 3 мл.
Концентрирование и хранение препарата фермента
Фракции, содержащие максимальную активность, объединяли, к ним добавляли BSA до концентрации 0,2 мг/мл и диализовали против 350 мл концентрирующего буфера (10 мМ Трис-HCl, pH 7,6; 0,1 мМ ЭДТА, 7 мМ β-меркаптоэтанол, 0,2 М NaCl, 50% глицерин) при перемешивании на магнитной мешалке в течение 16 ч. Препарат хранили при -20oС.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика штамма-продуцента
Исследуемый бактериальный штамм был нами выделен из пробы пресной воды в ходе поиска микроорганизмов – продуцентов эндонуклеаз рестрикции. Бактерия растёт на LM-агаре достаточно медленно: за 5 дней при 24оС образует круглые колонии до 3 мм в диаметре. Колонии приплюснутые, блестящие, полупрозрачные, бледно-розовые. Клетки – короткие палочки 0,7х2 – 3 мкм, редко-удлинённые, неподвижные, грамотрицательные, каталазо- и оксидазоположительные, аэробные. Растут при температуре от 20 до 30оС, но не при 8 или 37оС.
На основании морфолого-биохимических данных и анализа последовательности 16S рРНК (данные не приводятся) штамм идентифицировали как Paracoccus species 12. А обнаруженный фермент был назван PecI согласно общепринятой номенклатуре.
Получение препарата фермента PecI и изучение его свойств
В результате наработки культуры клеток штамма P. species 12 выход биомассы составил 2,1±0,5 г/л. После хроматографической очистки из 15 г биомассы было получено 6 мл препарата эндонуклеазы рестрикции PecI с концентрацией 10000 ед./мл.
В ходе дальнейшей работы нами были определены оптимальные условия для работы фермента. Для этого использовали реакционную смесь, содержащую 1 мкг ДНК фага Лямбда, один из шести буферов для эндонуклеаз рестрикции, исходный и разбавленный препарат фермента PecI, и два варианта температуры реакции – 37 и 55oС. Результаты приведены на рисунках 1 и 2.
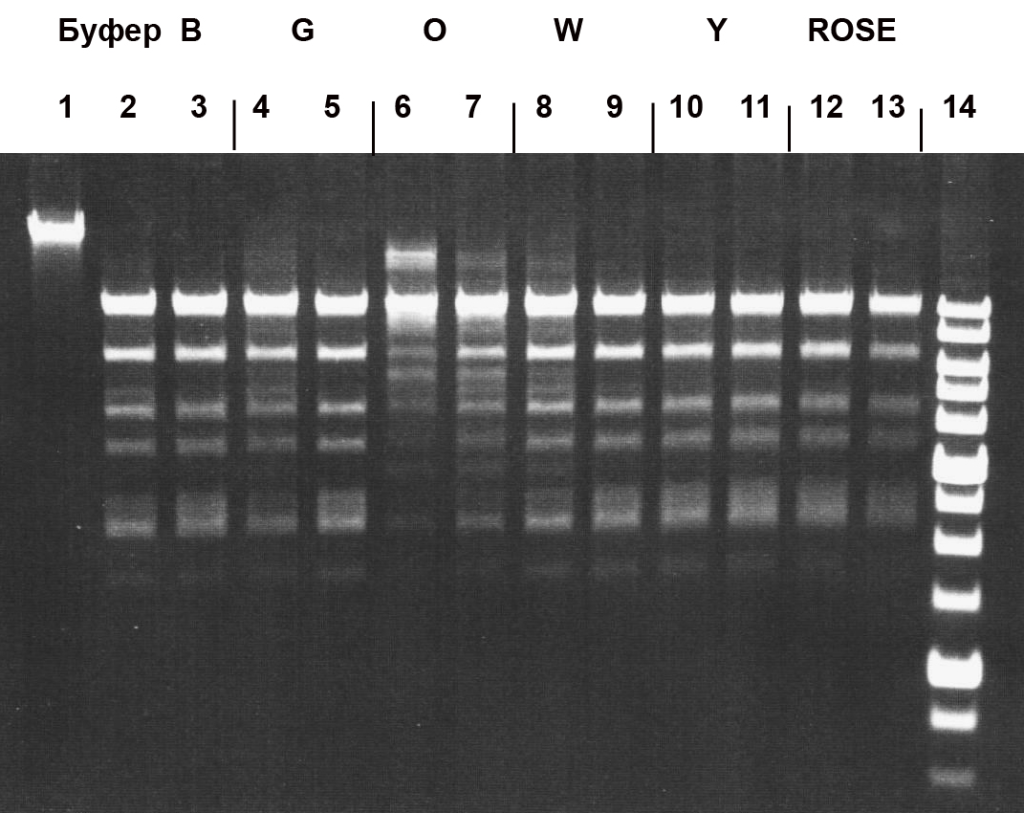
Рисунок 1
Электрофореграмма результатов измерения активности препарата фермента PecI в шести SE-буферах для эндонуклеаз рестрикции на ДНК фага Лямбда при 37oС.
Дорожки: 1 – исходная ДНК фага λ; 2, 4, 6, 8, 10, 12 – ДНК λ + 0,5 мкл препарата PecI, разбавленного в 10 раз SE-буфером “B100”; 3, 5, 7, 9, 11, 13 – ДНК λ + 1 мкл препарата PecI, разбавленного в 10 раз SE-буфером “B100”; 14 – 1 kb ДНК-маркеры молекулярного веса (от 0,25 до 10 т.п.н.). Продукты расщепления разделены в 0,8 % агарозном геле.
Рисунок 2
Электрофореграмма результатов измерения активности препарата фермента PecI при температурах 37 и 55oС в SE-буфере “Y” на ДНК фага Лямбда.
Дорожки: 1-4 – инкубация при 37oС; 6-9 – инкубация при 55oС; 5 – исходная ДНК фага λ; 1, 6 – ДНК λ + 0,5 мкл препарата PecI, разбавленного в 10 раз SE-буфером “B100”; 2, 7 – ДНК λ + 1 мкл препарата PecI, разбавленного в 10 раз SE-буфером “B100”; 3, 8 – ДНК λ + 2 мкл препарата PecI, разбавленного в 10 раз SE-буфером “B100”; 4, 9 – ДНК λ + 1 мкл неразбавленного препарата PecI; 10 – 1 kb ДНК-маркеры молекулярного веса (от 0,25 до 10 т.п.н.). Продукты расщепления разделены в 0,8 % агарозном геле.
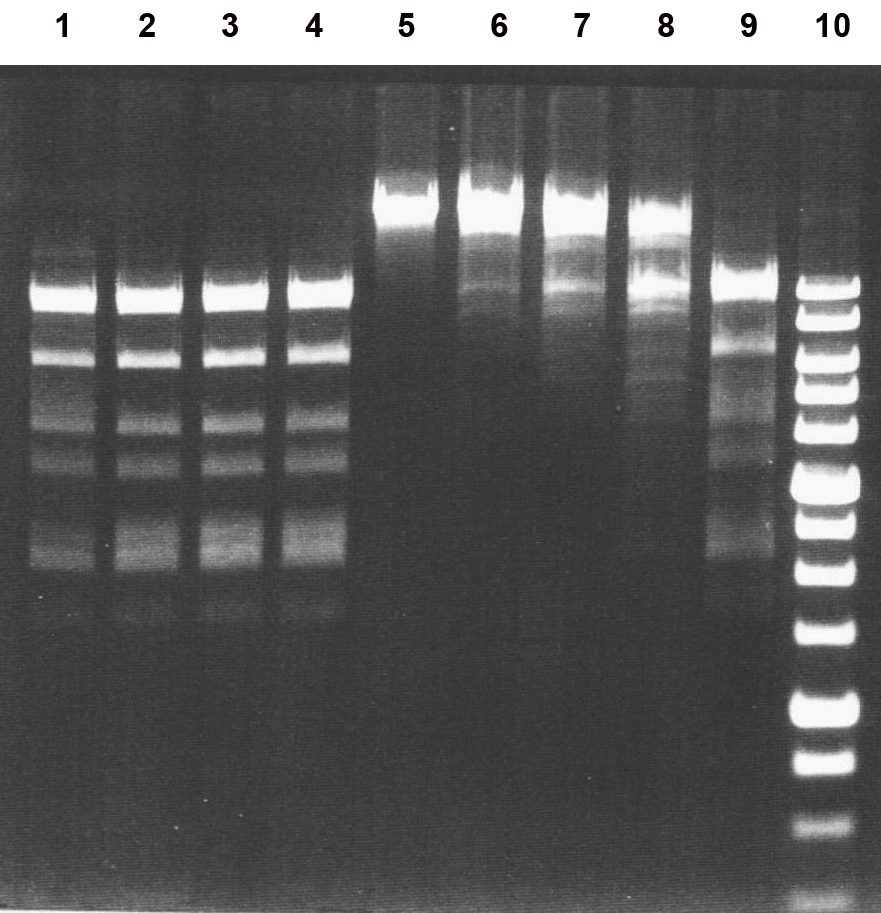
Анализ полученных результатов позволил заключить, что фермент проявляет максимальную активность в SE-буфере “Y” (33 мМ Трис-ацетат (pH 7,9), 10 мМ Mg-ацетат, 66 мМ K-ацетат, 1 мМ ДТТ) и универсальном буфере “ROSE” (рис.1, дор.10-13). Оптимальной температурой для работы ЭР PecI является температура 37oС (рис.2, дор.1-4). При этих условиях активность фермента составила 10000 ед./мл. Активность PecI при 55oС составила менее 10% от оптимальной. При этом полная инактивация ЭР PecI в реакционной смеси происходила при нагревании до 65oС за 20 мин (данные не приведены).
Сравнение полученной с помощью PecI картины гидролиза ДНК фага Лямбда с теоретически рассчитанными данными расщепления ее последовательности по сайтам эндонуклеаз рестрикции позволило сделать вывод, что фермент PecI гидролизует данный субстрат по сайту 5’-TTATAA-3’ и является, таким образом, изошизомером рестриктазы PsiI.
Для подтверждения этого результата нами был осуществлен совместный гидролиз ДНК фага Лямбда в SE-буфере “Y” при 37oС ферментами PecI и PsiI. Результаты приведены на рисунке 3.
Рисунок 3
Электрофореграмма результата совместного гидролиза ДНК фага Лямбда препаратами ферментов PecI и PsiI.
Дорожки: 1 – исходная ДНК λ; 2 – ДНК λ + 1 мкл препарата PecI; 3 – ДНК λ + 1 мкл препарата PsiI; 4 – ДНК λ + 1 мкл препарата PecI и 1 мкл препарата PsiI; 5 – 1 kb ДНК-маркеры молекулярного веса (от 0,25 до 10 т.п.н.). Продукты расщепления разделены в 0,8 % агарозном геле.
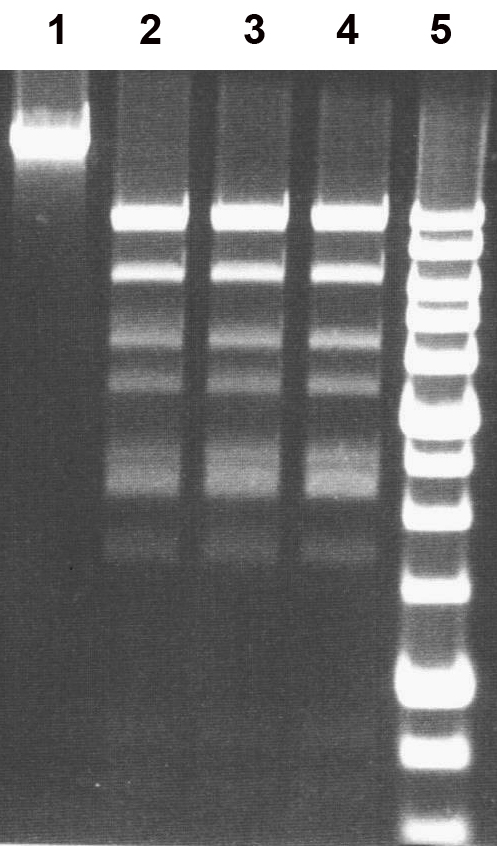
Поскольку при совместном гидролизе двумя ферментами никаких изменений в картине распределения фрагментов не возникает, можно сделать окончательный вывод об одинаковой субстратной специфичности PecI и PsiI.
Чтобы определить место гидролиза ДНК новым ферментом мы использовали двуцепочечный радиоактивно-меченый с 5’-конца олигонуклеотид (дуплекс) 11а*/11аК (меченая цепь отмечена *), содержащий сайт узнавания PsiI (подчеркнут):
11a*: 5’-CGAGTTTATAACTGGGCCCAAC-3’
11aK: 3’-GCTCAAATATTGACCCGGGTTG-5’
Данный дуплекс расщепляли новым ферментом PecI или контрольным ферментом PsiI.
Реакцию проводили с 1 пмоль дуплекса 11а*/11аК в 10 мкл реакционной смеси в течение 1 ч при 37oС в реакционном SE-буфере ”Y”. Продукты гидролиза наносили на 20% ПААГ с 8М мочевиной и проводили электрофорез в Трис-боратном буфере. На рисунке 4 представлена авторадиограмма геля после электрофореза.
Рисунок 4
Определение позиции гидролиза PecI на олигонуклеотидном дуплексе 11а*/11аК. Дорожки: 1 – исходный дуплекс 11а*/11аК; 2 – дуплекс 11а*/11аК + 1 мкл PecI; 3 – дуплекс 11а*/11аК + 1 мкл PsiI. Электрофорез в 20% ПААГ с 8М мочевиной.
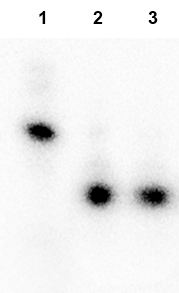
Из полученных данных следует, что позиция гидролиза PecI совпадает с позицией гидролиза PsiI (отмечена стрелкой): 5’-TTA^TAA-3’. Таким образом, PecI образует в результате гидролиза ДНК «тупые» концы и является истинным изошизомером PsiI.
В таблице 1 приведено сравнение активности ферментов PecI и PsiI в шести основных SE-буферах для эндонуклеаз рестрикции.
Таблица 1
Активность препаратов эндонуклеаз рестрикции PecI и PsiI в шести основных SE-буферах для эндонуклеаз рестрикции (в % от максимальной)
| SE Буфер | B | G | O | W | Y | ROSE |
| PecI | 50-75 | 75-100 | 10-25 | 25-50 | 100 | 100 |
| PsiI | 100 | 25-50 | 10-25 | 25-50 | 75-100 | 40 |
Новый фермент PecI может найти применение в области генетической инженерии, молекулярной биологии, биотехнологии и ДНК-диагностики. Благодаря 100%-ной активности в универсальном SE-буфере “ROSE” данную ЭР можно эффективно использовать для совместного (двойного) гидролиза ДНК рестриктазами.
Список литературы
- АбдурашитовA., Беличенко O.A., Лебедева Н.A., Дегтярев С.Х. 1999. Psi I, новая эндонуклеаза рестрикции, узнающая последовательность ДНК 5′-TTA^TAA-3′. Биохимия. 64, № 4, 481–482.
- Руководство к практическим занятиям по микробиологии. Под ред. Н.С. Егорова. М., 1995.
- Определитель бактерий Берджи. Под ред. Дж. Хоулта и др.: 9-е издание в 2-х томах. Пер. с англ. под ред. Г.А. Заварзина. М., 1997.
- Белавин П.А., Дедков В.С., Дегтярев С.Х. 1988. Метод определения эндонуклеаз рестрикции в колониях бактерий. Прикл. Биохим. Микробиол. 24, 121-124.