Эндонуклеаза рестрикции EmiI, изошизомер Ksp632I, узнает непалиндромную последовательность ДНК 5’-CTCTTC(1/4)-3’
М.А. Абдурашитов, Д.А. Гончар, В.А. Чернухин, В.С. Дедков, Н.А. Михненкова, А.А. Никонова, С.Х. Дегтярёв
М.А. Абдурашитов, Д.А. Гончар, В.А. Чернухин, В.С. Дедков, Н.А. Михненкова, А.А. Никонова, С.Х. Дегтярёв
ООО «СибЭнзайм», Новосибирск
* автор для переписки: М.А. Абдурашитов, ООО СибЭнзайм, ул. Тимакова, д. 2/12, Новосибирск, 630117, Россия; тел.: +7(383)333-4991; факс: +7(383)333-6853; E-mail: abd@sibenzyme.ru
РЕЗЮМЕ
Нами выявлен бактериальный штамм Exiguobacterium mexicanum 6, который является продуцентом новой эндонуклеазы рестрикции, названной EmiI. Фермент EmiI узнает шестинуклеотидную непалиндромную последовательность ДНК 5’-CTCTTC-3’ и расщепляет ее в стороне от сайта узнавания в позициях 1/4: 5’-CTCTTC(N)1↓-3’/3’-GAGAAG(N)4↓-5’ с образованием 5’-выступающих трехнуклеотидных концов. Таким образом, EmiI является изошизомером рестриктаз Ksp632I [1] и Bst6I [2]. Штамм-продуцент идентифицировали по морфологическим и биохимическим признакам, а также по анализу первичной структуры фрагмента гена 16S рРНК. Препарат эндонуклеазы рестрикции EmiI с концентрацией 5000 е.а./мл был получен путем очистки в три хроматографические стадии. Оптимальными условиями работы фермента являются SE-буфер Y (33 мМ Трис-ацетат (pH 7,9), 10 мМ Mg-ацетат, 66 мМ K-ацетат, 1 мМ ДТТ) и температура 37°С.
Список сокращений: BSA – бычий сывороточный альбумин; ДТТ – дитиотреитол; λ ДНК – ДНК бактериофага λ; Т7 ДНК – ДНК бактериофага Т7; е.а. – единицы активности; Трис – трис-(оксиметил)аминометан; ПААГ – полиакриламидный гель; п.н. – пар нуклеотидов; рестриктаза, ЭР – эндонуклеаза рестрикции; ЭДТА – этилендиамин-тетрауксусная кислота.
Ключевые слова: штамм-продуцент, выделение фермента, эндонуклеаза рестрикции IIS-типа, изошизомер.
DOI: 10.26213/3034-4301.2025.7.4.002
Данные для цитирования:
М.А. Абдурашитов, Д.А. Гончар, В.А. Чернухин, В.С. Дедков, Н.А. Михненкова, А.А. Никонова, С.Х. Дегтярёв (2025) Эндонуклеаза рестрикции EmiI, изошизомер Ksp632I, узнает непалиндромную последовательность ДНК 5’-CTCTTC(1/4)-3’ // ДНК-узнающие ферменты, том 2025(4), DOI:10.26213/3034-4301.2025.7.4.002

Эта статья доступна по лицензии Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International
ВВЕДЕНИЕ
Эндонуклеазы рестрикции IIS-типа [3] специфически расщепляют ДНК вне сайта узнавания, образуя уникальные липкие концы, что позволяет их применять в некоторых технологиях генетической инженерии и молекулярной биологии. Данная работа посвящена описанию новой эндонуклеазы рестрикции EmiI, узнающей непалиндромную шестинуклеотидную последовательность ДНК 5’-CTCTTC(N)1↓/3’-GAGAAG(N)4↓-5’ и расщепляющей ее, как показано стрелками.
УСЛОВИЯ ЭКСПЕРИМЕНТА
В работе использовались реактивы производства “Sigma-Aldrich” (США), “Fisher” (Германия), “Panreac” (Испания), “Диа-М” и “Хеликон” (Россия). Для хроматографической очистки фермента применялись следующие носители: фосфоцеллюлоза P11 и гепарин-сефароза (“Sigma-Aldrich ”, США), гидроксилапатит (“Bio-Rad”, США). Для выращивания бактериальных клеток использовались компоненты питательной среды фирмы ”Organotechnie” (Франция). Для экспериментов брали эндонуклеазы рестрикции, Т4 полинуклеотидкиназу, препараты ДНК фагов λ и Т7, маркеры молекулярного веса ДНК, реакционные SE-буферы для эндонуклеаз рестрикции «B100», «B», «G», «O», «W», «Y», «ROSE» производства ООО “СибЭнзайм” (Россия).
Морфологические и физико-биохимические свойства штамма изучали с использованием методик [4]. Определение рода микроорганизма проводили по определителю Берджи [5] и по результатам секвенирования ПЦР-фрагмента гена 16S рРНК.
Тестирование рестриктазной активности EmiI
В качестве субстрата для анализа активности EmiI использовали ДНК фага λ. При тестировании активности рестриктазы в хроматографическом профиле аликвоты по 1 мкл из фракций добавляли к 20 мкл реакционной смеси, содержащей 1 мкг ДНК фага λ в SE-буфере Y, инкубировали смесь в течение 15 мин при 37oС. При тестировании активности очищенного препарата EmiI брали 1 мкл неразбавленного фермента или 1 и 2 мкл препарата, разбавленного в 10 раз SE-буфером «B100» (10 мМ Трис-HCl, (pH 7,6), 50 мМ KCl, 0,1 мМ ЭДТА, 200 мкг/мл BSA, 1 мМ ДТТ, 50% глицерин). Фермент добавляли к 50 мкл реакционной смеси, содержащей 1 мкг ДНК фага λ и один из шести реакционных буферов для эндонуклеаз рестрикции. Смесь инкубировали в течение 1 ч при 37oС, продукты реакции наносили на 1% агарозный гель и проводили электрофорез в Трис-ацетатном буфере (50 мМ Трис-ацетат (pH 8,0), 20 мМ Na-ацетат, 2 мМ ЭДТА) при напряжении 180V. После окрашивания бромистым этидием гель фотографировали в УФ-свете. За единицу активности рестриктазы принимали минимальное количество фермента, необходимое для полного расщепления 1 мкг ДНК фага λ в SE-буфере Y при 37оС в 50 мкл реакционной смеси за 1 час.
Чтобы определить место гидролиза межнуклеотидных связей в ДНК изучаемым ферментом использовали олигонуклеотидный [32P]-меченый ДНК-дуплекс, содержащий сайт узнавания EmiI и сайты узнавания контрольных ферментов. Для разделения продуктов ферментативного гидролиза меченых олигонуклеотидов применяли электрофорез в 20% ПААГ, содержавшем 8 М мочевину.
Выращивание клеток штамма E. mexicanum 6
Штамм E. mexicanum 6 выращивали в 20 литровом ферментёре (New Brunswick, США) в LM-бульоне, содержащем: 1% триптон (Organotechnie, Франция), 0,5% дрожжевой экстракт (той же фирмы), 0,5% NaCl, 0,05% MgCl2 и 0,001% тиамин, при 30оС с перемешиванием и аэрацией 5 ч до ОП550 = 3. Клетки собирали центрифугированием на центрифуге Beckman J2-MI (США) в роторе JA-10 при 8000 об/мин в течение 20 мин и замораживали при -20оС.
Выделение эндонуклеазы рестрикции Emil
Условия проведения выделения и используемые буферы. Выделение проводили при +4оС с использованием растворов на основе буферов:
- буфер А — 10 мМ Трис-HCl, pH 7,6; 0,1 мМ ЭДТА и 7 мМ β-меркаптоэтанол;
- буфер Б — 10 мМ К-фосфат, pH 7,3; 0,1 мМ ЭДТА и 7 мМ β-меркаптоэтанол.
Экстрагирование. 17 г биомассы суспендировали в 60 мл буфера А, содержащего 0,1M NaCl, 1 мг/мл лизоцим, 0,1 мМ PMSF (фенилметилсульфонилфторид – ингибитор протеаз). После 2 часов перемешивания суспензии в стеклянном стакане на 150 мл в ледяной бане на магнитной мешалке клетки разрушали ультразвуком при максимальной мощности с амплитудой 22–24 мкм на приборе Soniprep 150 («MSE», Англия) с насадкой диаметром 2 см семью импульсами по 60 сек с интервалом 2 мин. Экстракт осветляли на центрифуге J2-М1 («Beckman», США) в течение 30 мин в роторе JA-20 при 15000 об/мин.
Хроматография на фосфоцеллюлозе Р-11. Осветленный экстракт наносили на колонку с фосфоцеллюлозой P11, объемом 60 мл, предварительно уравновешенной буфером А с 0,1М NaCl, колонку промывали 120 мл буфера А с 0,1М NaCl. Сорбированный материал элюировали линейным градиентом концентрации NaCl 0,1–0,8 М в буфере А, объемом 600 мл. Собирали 60 фракций по 10 мл. Объединяли фракции, содержащие максимум активности (42-54).
Хроматография на гидроксилапатите. Объединенную фракцию наносили на колонку с гидроксилапатитом объемом 8 мл, уравновешенным буфером Б с 50 мМ NaCl и промывали 15 мл того же буфера. Фермент элюировали линейным градиентом 20–300 мМ калий–фосфата в буфере Б c 50 мМ NaCl объемом 300 мл. Собирали 50 фракций по 6 мл. Фракции с максимальной активностью (24-29) объединяли и диализовали против 2 л буфера А в течение 1,5 ч.
Хроматография на гепаринсефарозе. Объединенную фракцию после диализа наносили на колонку с гепарин-сефарозой объемом 5 мл, предварительно уравновешенной буфером А с 50 мМ NaCl и промывали 10 мл того же буфера. Сорбированный материал элюировали линейным градиентом концентрации NaCl 50–800 мМ в буфере А объемом 80 мл. Собирается 40 фракций по 2 мл. Фракции, содержащие максимальную активность фермента (18-23), объединяли.
Концентрирование и хранение препарата
В объединенную фракцию добавляли BSA до концентрации 0,2 мг/мл, после чего проводили диализ против 200 мл концентрирующего буфера (10 мМ Трис-HCl, pH 7,6; 0,1 мМ ЭДТА, 7 мМ β-меркаптоэтанол, 0,2 М NaCl, 50% глицерин) при перемешивании на магнитной мешалке в течение 16 ч. Препарат хранили при минус 20°С
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика и таксономическая идентификация штамма.
Штамм-продуцент выделен из воды пруда. На LM-агаре за 3 дня при 24оС образует круглые колонии до 4 мм в диаметре. Колонии конически-выпуклые, блестящие, непрозрачные, бледно-оранжевые. Клетки палочковидные, 0,6 х 3 – 4 мкм, подвижные, грамположительные, каталазоположительные, оксидазоотрицательные. Растут в аэробных условиях при температуре от 8 до 40оС, не растут при 55оС. Содержание 53±5% G+C в ДНК штамма определяли по [6].
Для идентификации штамма по 16S рРНК из клеток штамма выделяли ДНК и проводили ПЦР гена 16S рРНК с использованием праймеров 5’-agagtttgatcmtggctca-3’ и 5’-tacggytaccttgttacgact-3’, представляющих модификации fDl и rPl [7]. Секвенировали ПЦР-фрагмент длиной 721 п.н. части гена 16S рРНК (рис. 1).
Рисунок 1
Нуклеотидная последовательность фрагмента гена 16S рРНК штамма-продуцента
1 ATGCAGTCGA GCGCAGGACA TCGACGGAAC CCTTCGGGGG GAAGTCGACG GAATGAGCGG 61 CGGACGGGTG AGTAACACGT AAAGAACCTG CCCTCAGGTC TGGGATAACC ACGAGAAATC 121 GGGGCTAATA CCGGATGGGT CATCGAACCG CATGGTTCGA GGATGAAAGG CGCTTCGGCG 181 TCGCCTGGGG ATGGCTTTGC GGTGCATTAG CTAGTTGGTG GGGTAATGGC CCACCAAGGC 241 GACGATGCAT AGCCGACCTG AGAGGGTGAT CGGCCACACT GGGACTGAGA CACGGCCCAG 301 ACTCCTACGG GAGGCAGCAG TAGGGAATCT TCCACAATGG ACGAAAGTCT GATGGAGCAA 361 CGCCGCGTGA ACGATGAAGG CCTTCGGGTC GTAAAGTTCT GTTGTAAGGG AAGAACAAGT 421 GCCGCAGGCA ATGGCGGCAC CTTGACGGTA CCTTGCGAGA AAGCCACGGC TAACTACGTG 481 CCAGCAGCCG CGGTAATACG TAGGTGGCAA GCGTTGTCCG GAATTATTGG GCGTAAAGCG 541 CGCGCAGGCG GCCTCTTAAG TCTGATGTGA AAGCCCCCGG CTCAACCGGG GAGGGCCATT 601 GGGAAACTGG GAGGCTTGAG TATAGGAGAG AAGAGTGGAA TTCCACGTGT AGCGGTGAAA 661 TGCGTAGAGA TGTGGAGGAC ACCAGTGGCG AAGGCGACTC TTTTGGGCCT ATACTGACGC 721 TGA
На основе установленной последовательности фрагмента гена 16S рРНК определили принадлежность штамма-продуцента к Exiguobacterium mexicanum семейства Bacillales Family XII. Incertae Sedis. Для этого использовали Nucleotide BLAST [8], определитель SILVAngs [9] и классификатор [10]. Микробиология штамма соответствовала его роду [11]. Штамм назвали Exiguobacterium mexicanum 6, а выделенную из него рестриктазу, по номенклатуре, EmiI.
Получение препарата фермента EmiI и изучение его свойств.
В результате наработки культуры клеток штамма E. mexicanum 6 из 20 л среды получили 64 г биомассы с активностью EmiI 50 000 ед./г. После трёх стадий хроматографической очистки из 17 г биомассы было получено 3 мл препарата эндонуклеазы рестрикции EmiI с концентрацией 5000 е.а./мл.
В ходе дальнейшей работы нами были определены оптимальные условия для работы фермента. Для этого использовали реакционную смесь объемом 50 мкл, содержащую 1 мкг ДНК фага λ, один из шести буферов для эндонуклеаз рестрикции и 1 или 2 мкл препарата фермента EmiI, разбавленного в 10 раз SE-буфером «B100». Смесь инкубировали при температуре 37oС в течение 1 ч. Результаты приведены на рисунке 2.
Рисунок 2
Активность препарата EmiI на ДНК фага λ при температуре 37оС в разных SE-буферах: B, G, O, W, Y и ROSE. Электрофорез в 1% агарозном геле.
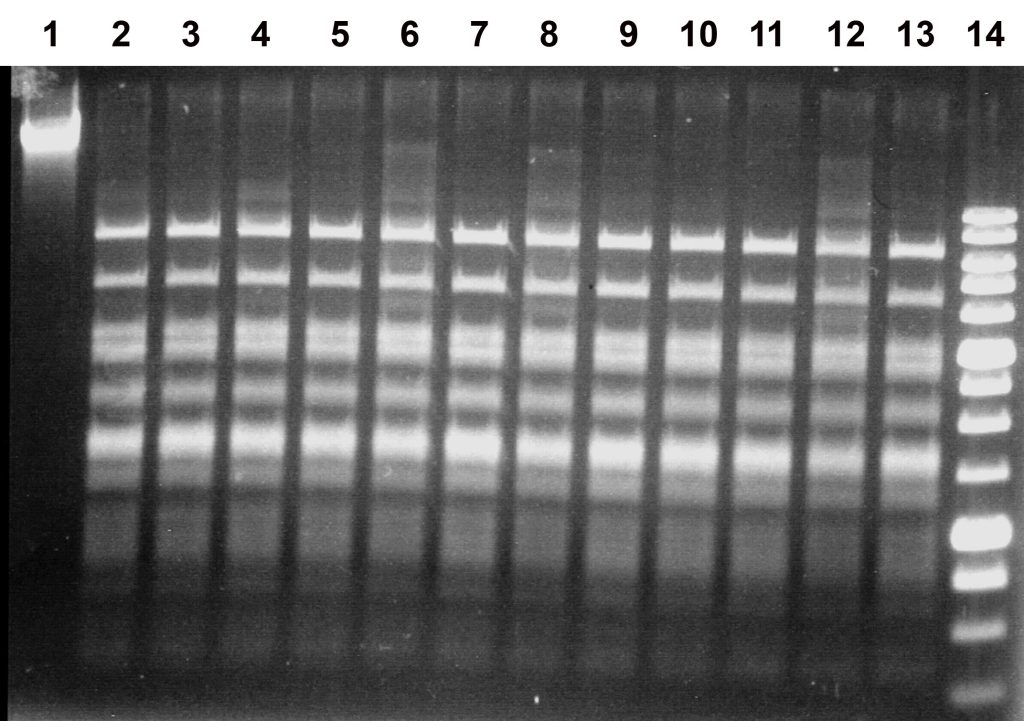
Дорожки:
1 – исходная λ ДНК;
2, 4, 6, 8, 10, 12 – λ ДНК + 1 мкл разбавленного в 10 раз EmiI;
3, 5, 7, 9, 11, 13 – λ ДНК + 2 мкл разбавленного в 10 раз EmiI;
2-3 – SE-буфер B;
4-5 – SE-буфер G;
6-7 – SE-буфер O;
8-9 – SE-буфер W;
10-11 – SE-буфер Y;
12-13 – SE-буфер ROSE;
14 – SE-маркёр молекулярных весов ДНК 1 kb.
Из рисунка 2 видно, что фермент проявляет максимальную активность в SE-буфере Y (33 мМ Трис-ацетат (pH 7,9), 10 мМ магний-ацетат, 66 мМ калий-ацетат, 1 мМ ДТТ), поскольку в нем наблюдается полный гидролиз субстратной ДНК при добавлении как 1, так и 2 мкл разбавленного в 10 раз фермента (дор.10-11). Во всех остальных случаях 1 мкл разбавленного препарата EmiI недостаточно для исчерпывающего гидролиза ДНК. Полученные результаты анализа активности фермента в шести SE-буферах при температуре 37оС представлены в таблице 1.
Таблица 1
Активность препаратов эндонуклеаз рестрикции MoxI и GlaI в шести основных SE-буферах для эндонуклеаз рестрикции (в % от максимальной).
| SE буфер | B | G | O | W | Y | ROSE |
| Активность EmiI, % |
75–100 | 50–75 | 25–50 | 25–50 | 100 | 25 |
Сравнение полученной с помощью EmiI картины гидролиза ДНК фага λ с теоретически рассчитанными данными расщепления ее последовательности по сайтам эндонуклеаз рестрикции позволило сделать вывод, что фермент EmiI является изошизомером рестриктаз Ksp632I [1] и Bst6I [2], которые гидролизуют данный субстрат по сайту 5’-CTCTTC-3’/3’-GAGAAG-5’.
Чтобы подтвердить специфичность нового фермента мы провели сравнительный гидролиз ДНК фагов λ и Т7 эндонуклеазами рестрикции EmiI и Bst6I в 50 мкл реакционной смеси, содержащей 1 мкг ДНК в SE-буфере Y и 1 мкл препарата ЭР Bst6I либо EmiI. После инкубации реакционных смесей при 65оС (для Bst6I) или 37оС (для EmiI) в течение 1 ч аликвоты по 15 мкл наносили на 1% агарозный гель и проводили электрофорез. Результаты представлены на рисунке 3.
Рисунок 3
Определение специфичности эндонуклеазы рестрикции EmiI на ДНК фагов λ и T7.
Продукты разделены в 1% агарозном геле.
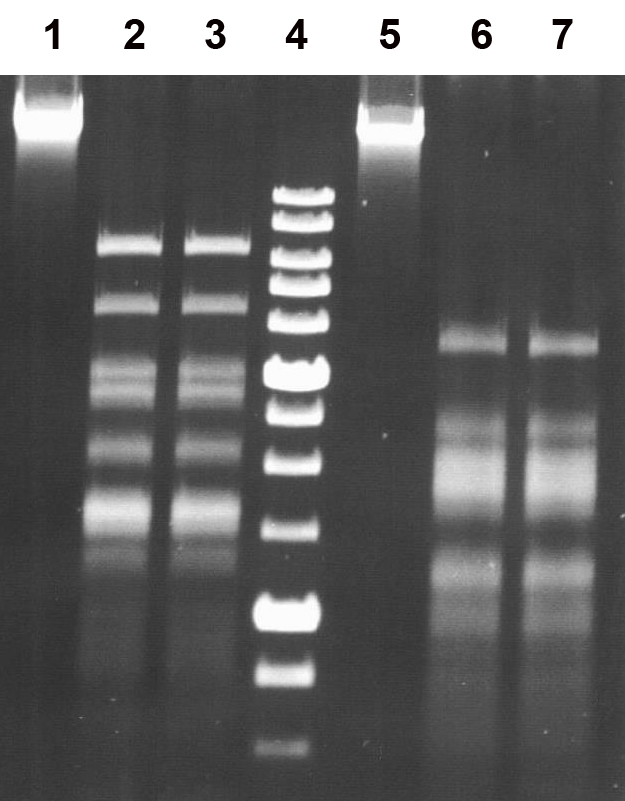
Дорожки:
1 – исходная ДНК фага λ;
2 – ДНК фага λ + 1 мкл препарата Bst6I;
3 – ДНК фага λ + 1 мкл препарата EmiI;
5 – исходная ДНК фага T7;
6 – ДНК фага T7 + 1 мкл препарата Bst6I;
7 – ДНК фага T7 + 1 мкл препарата EmiI;
4 – SE-маркёр молекулярных весов ДНК 1 kb.
Из рисунка видно, что картины гидролиза обеих ДНК рестриктазами Bst6I и EmiI полностью совпадают, что подтверждает их одинаковую специфичность.
При определении оптимальной температуры для работы ЭР EmiI проводили инкубацию в 50 мкл реакционной смеси 1 мкг ДНК фага λ в SE-буфере Y и 1 мкл исходного или 1 мкл разбавленного в 10 раз препарата фермента в течение 1 ч при температурах 25, 30, 37, или 55оС. Результаты представлены на рисунке 4.
Рисунок 4
Активность препарата EmiI на ДНК фага λ в SE-буфере Y при различных температурах.
Электрофорез в 1% агарозном геле

Дорожки:
1 – исходная ДНК фага λ;
2 и 3 – ДНК фага λ + 1 мкл исходного либо 1 мкл разбавленного EmiI, 25оС;
4 и 5 – ДНК фага λ + 1 мкл исходного либо 1 мкл разбавленного EmiI, 30оС;
6 и 7 – ДНК фага λ + 1 мкл исходного либо 1 мкл разбавленного EmiI, 37оС;
8 и 9 – ДНК фага λ + 1 мкл исходного либо 1 мкл разбавленного EmiI, 55оС;
10 – SE-маркёр молекулярных весов ДНК 1 kb.
Как видно из рис.4, полный гидролиз субстратной ДНК 1 мкл неразбавленного препарата EmiI наблюдается при любой из проверяемых температур (дор. 2, 4, 6, 8). Тогда как в реакции с разбавленным в 10 раз ферментом только при 37oС можно наблюдать исчерпывающий гидролиз субстрата ферментом (дор. 7). Следовательно, данная температура является оптимальной для активности рестриктазы EmiI. При этом полная инактивация ЭР EmiI происходила при нагревании реакционной смеси до 80oС за 20 мин (данные не приведены).
На основании полученных результатов можно определить активность препарата EmiI. На рисунке 5 приведена электрофореграмма анализа активности целевого фермента при оптимальной температуре (37°С) в оптимальном SE-буфере Y.
Рисунок 5
Определение активности EmiI в оптимальных условиях. Пробы по 50 мкл, содержащие 1 мкг ДНК фага λ в SE-буфере Y и 1 мкл неразбавленного (контроль) или 0,5, 1, 2 мкл разбавленного в 10 раз буфером «B100» препарата EmiI.
Смесь инкубировали 1 ч при 37°С и анализировали электрофорезом в 1% агарозном геле.

Дорожки:
1 – исходная ДНК фага λ;
2 – ДНК фага λ + 0,5 мкл разбавленного в 10 раз препарата EmiI;
3 – ДНК фага λ + 1 мкл разбавленного в 10 раз препарата EmiI;
4 – ДНК фага λ + 2 мкл разбавленного в 10 раз препарата EmiI;
5 – ДНК фага λ + 1 мкл неразбавленного препарата EmiI;
6 – SE-маркёр молекулярных весов ДНК 1 kb.
Из рисунка видно, что исчерпывающий гидролиз рестриктазой EmiI λ ДНК наблюдается при добавлении 2 мкл разбавленного в 10 раз препарата фермента (дор. 4) или 1 мкл неразбавленного препарата фермента (дор. 5). Таким образом, можно сделать заключение, что активность исследуемого препарата ЭР EmiI составляет 5 е.а./мкл (5000 е.а./мл). За единицу активности рестриктазы EmiI принимали минимальное количество фермента, необходимое для полного расщепления 1 мкг ДНК фага λ в реакционной смеси объемом 50 мкл за 1 ч в SE-буфере Y при 37°С.
Чтобы подтвердить сайт узнавания ЭР EmiI и определить место гидролиза ДНК новым ферментом мы использовали 2 радиоактивно меченых с 5’-конца олигонуклеотидных дуплекса Emi1*/Emi2 и Emi2*/Emi1 (меченая цепь отмечена «*»), образованные из двух олигонуклеотидов, содержащих сайт узнавания EmiI (подчеркнут):
Emi1: 5’-CCTTTGACGCTCTTCGGCGCCATGATG CAA CC-3’ Emi2: 5’-GGTTGCATCATGGCGCCGAAGAGCGTCAAAGG -3’
Данный дуплекс расщепляли новым ферментом EmiI и, отдельно, контрольными ферментами Bst6I (5’-CTCTTC(1/4)-3’), HgaI (5’-GACGC(5/10)-3’), HspAI (5’-G↓CGC-3’), FaeI (5’-CATG↓-3’), SfaNI (5’-GCATC(5/9)-3’). Реакцию проводили с 1 пмоль дуплексов Emi1*/Emi2 и Emi2*/Emi1 в 10 мкл реакционной смеси в течение 1 ч при 37°С (для Bst6I при 55°С) в реакционном SE-буфере Y. Продукты гидролиза наносили на 20% ПААГ с 8М мочевиной и проводили электрофорез в Трис-боратном буфере. На рисунке 6А представлен авторадиограмма геля после электрофореза.
Рисунок 6A
Определение позиции гидролиза EmiI. Электрофорез в 20% ПААГ с 8М мочевиной.
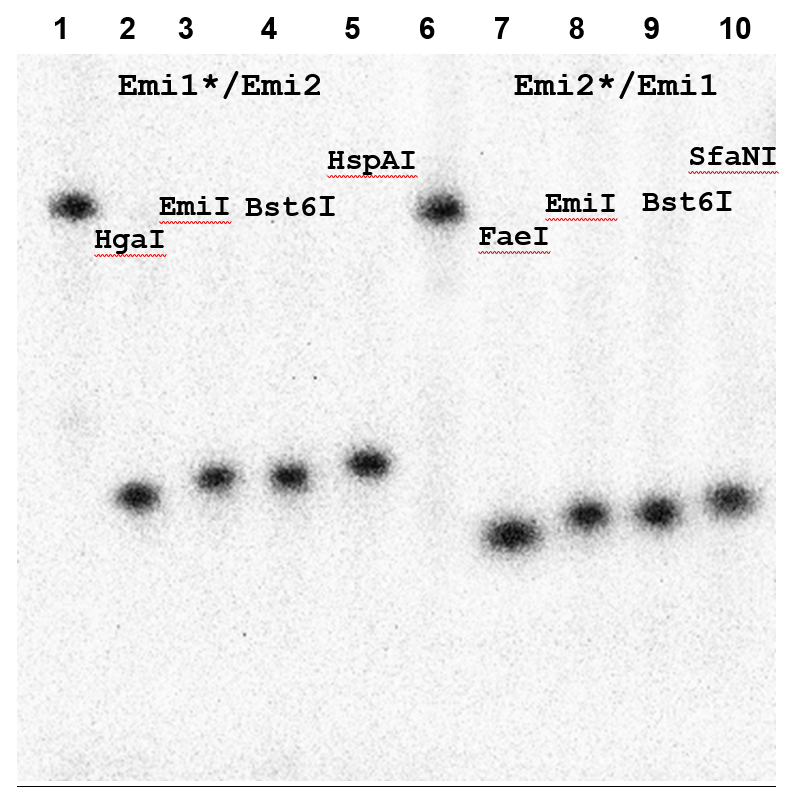
Дорожки:
1 – исходный дуплекс Emi1*/Emi2;
2 – дуплекс Emi1*/Emi2 + 1 мкл HgaI;
3 – дуплекс Emi1*/Emi2 + 1 мкл EmiI;
4 – дуплекс Emi1*/Emi2 + 1 мкл Bst6I;
5 – дуплекс Emi1*/Emi2 + 1 мкл HspAI;
6 – исходный дуплекс Emi2*/Emi1;
7 – дуплекс Emi2*/Emi1+ 1 мкл FaeI;
8 – дуплекс Emi2*/Emi1+ 1 мкл EmiI;
9 – дуплекс Emi2*/Emi1+ 1 мкл Bst6I;
10 – дуплекс Emi2*/Emi1+ 1 мкл SfaNI.
На рисунке 6Б приведена структура дуплекса Emi1/Emi2 с указанием сайтов узнавания и позиций гидролиза ЭР, используемых для анализа. Для удобства сайты узнавания и стрелочки, обозначающие позиции гидролиза, для каждой ЭР выделены отдельным цветом. Для каждой цепи дуплекса ферменты были подобраны так, чтобы их позиции гидролиза либо совпадали (как у Bst6I) с предполагаемой позицией гидролиза EmiI, либо отличались на 1 нуклеотид с 5’-конца (HgaI для верхней цепи и FaeI для нижней цепи) или на 1 нуклеотид с 3’-конца (HspAI для верхней цепи и SfaNI для нижней цепи).
Рисунок 6Б
Схема олигонуклеотидоного дуплекса Emi1/Emi2 с указанием сайтов узнавания и точек расщепления контрольных ферментов.

Из данных, представленных на рисунке 6А, следует, что позиция гидролиза EmiI совпадает с позицией гидролиза Bst6I (5’-CTCTTCN↓-3’/3’-GAGAAGNNNN↓-5’) и отличается на 1 нуклеотид в ту или другую сторону, соответственно, от позиций гидролиза контрольных ферментов.
Таким образом, эндонуклеаза рестрикции EmiI из штамма бактерии Exiguobacterium mexicanum 6 узнает шестинуклеотидную непалиндромную последовательность ДНК 5’-CTCTTC-3’ и расщепляет ее в стороне от сайта узнавания в позициях 5’-CTCTTC(N)1↓-3’/3’-GAGAAG(N)4↓-5’ с образованием 5’-выступающих трехнуклеотидных концов, как и в случае ранее описанных рестриктаз Ksp632I и Bst6I. Новый фермент может применяться для исследований в области генетической инженерии, молекулярной биологии, биотехнологии и ДНК-диагностики.
Список литературы
- Bolton B.J., Schmitz G.G., Jarsch M., Comer M.J., Kessler C. Ksp632I, a novel class-IIS restriction endonuclease from Kluyvera sp. strain 632 with the asymmetric hexanucleotide recognition sequence: 5′-CTCTTC(N)1-3′ 3′-GAGAAG(N)4-5′. Gene. Jun 15; 66(1) (1988) 31-43. DOI 10.1016/0378-1119(88)90222-3
- Эндонуклеаза рестрикции Bst6I // http://sibenzyme.com/product/bst6-i/
- Pingoud A., Fuxreiter M., Pingoud V. and Wende W. Type II restriction endonucleases: structure and mechanism. CMLS, Cell. Mol. Life Sci. 62 (2005) 685–707. 1420-682X/05/060685-23. DOI 10.1007/s00018-004-4513-1.
- Руководство к практическим занятиям по микробиологии. Под ред. Н.С. Егорова. М., 1995.
- Определитель бактерий Берджи. Под ред. Дж. Хоулта и др.: 9-е издание в 2-х томах. Пер. с англ. под ред. Г.А. Заварзина. М., 1997.
- Дедков В.С. Определение содержания G+C в ДНК бактерий при помощи эндонуклеаз рестрикции // Биотехнология. – 2004. – № 4. – С. 77-82.
- Weisburg W.G., Barns S.M., Pelletier D.A., Lane D.J. 16S ribosomal DNA amplification for phylogenetic study // J. Bacteriol. – 1991. – Vol. 173. – P. 697 – 703., DOI: 10.1128/jb.173.2.697-703.1991.
- Nucleotide BLAST. URL: https://blast.ncbi.nlm.nih.gov
- SILVAngs. URL: https://www.arb-silva.de/aligner
- NCBI Taxonomy Browser URL: https://www.ncbi.nlm.nih.gov/Taxonomy/
- Raichand R., Pareek S., Singh N.K., Mayilraj S. Exiguobacterium aquaticum sp. nov., a member of the genus Exiguobacterium // Int. J. Syst. Evol. Microbiol. – 2012. – V. 62. – P. 2150-2155. DOI: 10.1099/ijs.0.035790-0
